تحضير درس التعادل مادة كيمياء 4 مقررات

تحضير درس التعادل مادة كيمياء 4 مقررات من أهم الميزات التي تجعل عددًا كبيرًا من معلمي مادة الكيمياء 4 مقررات يتجهون إلى التحاضير التي تقدمها مؤسسة التحاضير الحديثة هي أن هذه التحاضير تحتوي على كل ما يتعلق بالموضوع ، بما في ذلك الأساليب والمكونات والنماذج المجانية ، بالإضافة إلى الاستراتيجيات الحديثة والمتطورة والمرفقات الهامة .
تحضير درس التعادل مادة كيمياء 4 مقررات
تعدد طرق وأساليب شرح المواد التعليمية لدى مؤسسة التحاضير الحديثة ، حيث يوجد داخل ملف التحاضير مجموعة كبيرة ومختلفة من طرق شرح دروس المادة .
بوربوينت درس التعادل مادة كيمياء 4 مقررات [varnumber]

مكونات مادة كيمياء 4 مقررات [varnumber]
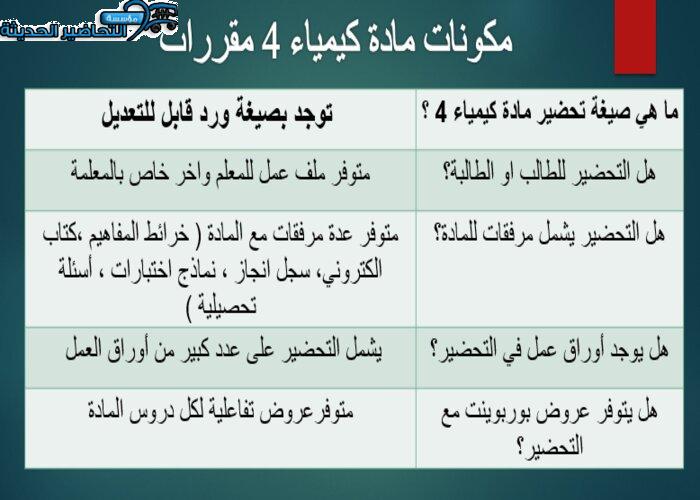
طرق تحضير مادة كيمياء 4 مقررات [varnumber]

يمكنك الاطلاع على نسخة مجانية من تحضير مادة كيمياء 4 مقررات [varnumber]
يمكنك معرفة أسعار تحضير مادة كيمياء 4 مقررات [varnumber]
يمكنك تقديم طلبك لشراء تحضير مادة كيمياء 4 مقررات [varnumber]
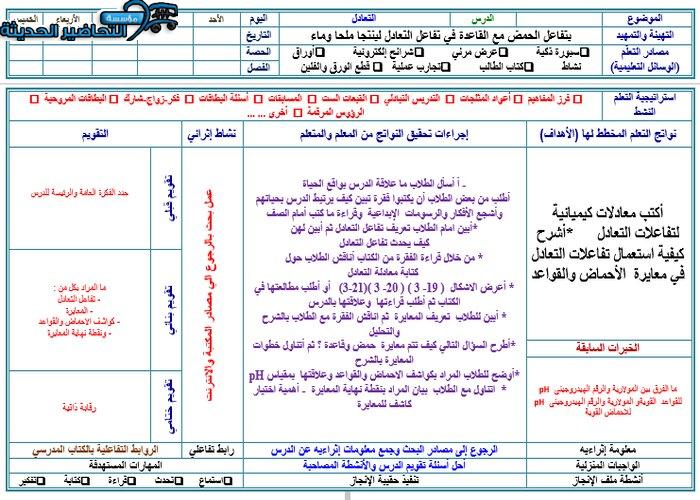
شرح درس التعادل مادة كيمياء 4 مقررات
التعادل :
التعادل في الكيمياء هي تفاعل كيميائي بين مقادير متكافئة من حمض وقاعدة لتكوين ملح ، عادة (ولكن ليس بالضرورة) ماء ، تفاعل معادلة بين هيدروكسيد الصوديوم وحمض الهيدروكلوريك ، الدليل أزرق بروموثيمول ، أحد أشهر الأمثلة على تفاعلات التعادل هو تفاعل حمض الهيدروكلوريك مع هيدروكسيد الصوديوم لإعطاء ملح الطعام (كلوريد الصوديوم) والماء .
تطبيقات التعادل :
- طرق المعايرة بالتحليل الحجمي : تستخدم طريقة المعايرة الكيميائية لتحديد تركيزات غير معروفة للأحماض أو القواعد من خلال إيجاد نقطة حيادها لإيجاد النقطة التي يحدث فيها التعادل ، نستخدم مؤشر الأس الهيدروجيني أو مقياس الأس الهيدروجيني بمساعدة حسابات القياس المتكافئ البسيطة ومعرفة حجم الكمية المعروفة ، يمكن حساب العينة غير المعروفة .
- يجب أن نساوي سميته قبل التخلص منه. اعتمادًا على نوع المادة السامة ، يتم استخدام مواد كيميائية مختلفة لتحييدها وتقليل سميتها ، بعض الأمثلة الشائعة هي صودا الخبز وهيدروكسيد المغنيسيوم وأكسيد الكالسيوم وكربونات الكالسيوم .
- توليف المواد : لتسهيل الاختزال الكيميائي للمعادن المشاركة في التصنيع ، يتم استخدام حرارة تفاعل التعادل.
- في جهازنا الهضمي : عندما ينتقل الطعام بين المعدة والأمعاء ، يجب أن يتساوى الطعام. ولكن من أجل امتصاص العناصر الغذائية من خلال جدران الأمعاء ، يلزم وجود بيئة قلوية .
- التحكم في درجة حموضة التربة :لتحقيق النمو الأمثل للنبات في أي تربة ، يلزم وجود شروط معينة .
تظهر الحسابات الكيميائية أساس طريقة المعايرة ، والتي تستخدم لتحديد تركيزات المحاليل الحمضية والقاعدية ، المعايرة هي طريقة لتحديد تركيز محلول مائي ؛ يتم ذلك عن طريق تفاعل حجم معروف مع محلول بتركيز معروف ، إذا كنت ترغب في إيجاد تركيز محلول حمضي ، فسوف تقوم بمعايرته بمحلول أساسي بتركيز معروف. يمكنك أيضًا معايرة قاعدة ذات تركيز غير معروف بحمض بتركيز معروف. كيف تسمي حمض وقاعدة؟ يوضح الشكل 3-21 نوعًا واحدًا من المعدات المستخدمة في عملية المعايرة في هذه الطريقة ، يتم استخدام مقياس الأس الهيدروجيني لمراقبة التغير في قيم الأس الهيدروجيني أثناء عملية المعايرة .
الكواشف ونقطة نهاية المعايرة :
العديد من الكواشف المستخدمة في المعايرة عبارة عن أحماض ضعيفة ، ولكل منها قيمة الأس الهيدروجيني أو نطاق الأس الهيدروجيني الذي يتغير لونه بعد ذلك تسمى النقطة التي يتغير عندها الكاشف بنقطة نهاية المعايرة أما بالنسبة لنقطة التكافؤ ، فهي النقطة التي يكون عندها عدد مولات الحمض مساويًا لعدد مولات القاعدة لذلك ، من المهم اختيار المعايير الذي يغير لونه عند نقطة معادلة المعايرة الصحيحة. تذكر أن دور الكاشف هو أن يوضح لك بدقة ، من خلال تغيير لونه ، أنه تمت إضافة ما يكفي من المحلول القياسي ليساوي الحل المجهول يصف الشكل 3-25 طريقة لمعايرة محلول بتركيز غير معروف من حمض الميثانويك ، HCOOH ، بمحلول 0.1000 مولار هيدروكسيد الصوديوم .



